Wenn ein realen Gases abgekühlt wird, verflüssigt
es sich bei einer bestimmten Verflüssigungstemperatur, ebenso
bei Druckerhöhung. Bei einem idealen Gas ist das nicht der Fall. Die
eintretende Verflüssigung muss auch in einem p-V-Diagramm (bei jeweils
konstanter Temperatur) oder in einem p-T-Diagramm (bei konstantem
Volumen) erscheinen. Die potenzielle Energie infolge gegenseitiger
Wechselwirkung der Gasteilchen ist bei realen Gasen gegenüber der
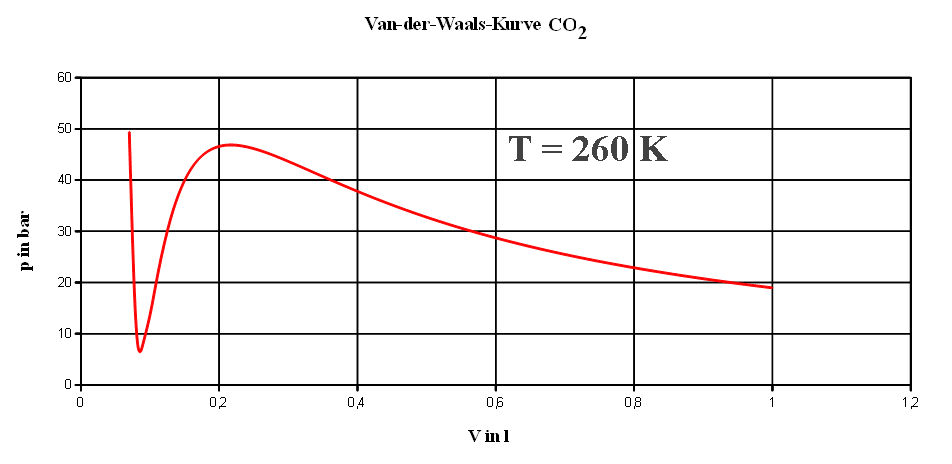
kinetischen Energie nicht vernachlässigbar. Van der Waals hat empirische
Kurven gefunden, die in einem p-V-Diagramm mit T als Parameter
dargestellt werden. Es handelt sich um Isothermen (iso = gleich).
 |
| [ p + a·(n/V)2
]·(V - n·b) = n·R·T |
Dabei ist:
p Druck in Pa, V Volumen in m3, T
absolute Temperatur in K, n Molzahl in mol, R allgemeine
Gaskonstante R = 8,314 J/(K·mol), a
Binnendruckkoeffizient in Nm4/mol2, b
Eigenvolumen in m3/mol
Für ein ideales Gas wären a = b = 0.
|
| nach Harrison, Datenbuch Chemie Physik, Vieweg
1982, korrigiert |
Wasserstoff |
Luft |
CO2 |
Butan |
| a in N·m4/mol2 = Pa·m6·mol-2 |
0,0247 |
0,14 |
0,3636 |
1,466 |
| b in m3/mol |
26,7 |
39,1·10-6 |
42,67·10-6 |
122,6·10-6 |
Gründe für die Abweichungen gegenüber idealen Gasen sind
1. das Eigenvolumen der Atome oder Moleküle des
Gases. Während die punktförmig angenommenen Atome eines idealen Gases
beliebig angenähert werden können, gibt es bei den ausgedehnten
Bestandteilen des realen Gases Grenzen der Annäherung. Das Eigenvolumen
aller Atome bzw. Moleküle des Gases verringert das zur Verfügung
stehende Volumen.
2. Die Bestandteile eines realen Gases üben Kräfte
aufeinander aus. Auf die Gasteilchen entsteht an der Oberfläche des
Gasvolumens eine Anziehungskraft "nach innen", die den auf die Wand
wirkenden Gasdruck verrringert. Das wird berücksichtigt durch einen Binnendruck.
Du erkennst die Druckverminderung, wenn du die
Van-der-Waals-Gleichung nach p auflöst: p = n·R·T/(V - n·b) - a·(n/V)2
.
Wie beim idealen Gas wirken bei Stößen abstoßende
Kräfte. Kommen sich die Atome bzw. Moleküle sehr nahe, entstehen
weitere anziehende Kräfte: Sie sind der Grund für die Verflüssigung
bei großem Druck oder kleiner Temperatur: das Gas wird flüssig.
Teile der Van-der-Waals-Kurve sind unphysikalisch: Würde
man das Volumen verkleinern, würde in einem bestimmten Bereich auch der
Druck sinken und erst bei noch kleinerem Volumen wieder ansteigen. Bei
bestimmten Parametern wäre der Druck sogar negativ. Zur Korrektur hat
Maxwell die so genannte Maxwell-Gerade vorgeschlagen, die sich
mit dem Energieerhaltungssatz auch begründen lässt:
Maxwell'sche Konstruktion:
Zeichne eine Strecke (grün) so ein, dass im V-p-Diagramm
für eine Isotherme die beiden Flächenanteile unter und über der
Maxwell-Geraden gerade gleich sind (gelb). Wird das reale Gas abgekühlt,
beginnt es bei einem Volumen V1 nach und nach flüssig zu
werden, wobei der Druck konstant bleibt. Im Bereich von V1
bis V2 treten Gas und Flüssigkeit (bei konstantem
Gasdruck) gemeinsam auf. Bei noch kleinerem Volumen ist das ganze Gas in
den flüssigen Zustand übergegangen.
(Isotherme: immer gleiche Temperatur, da iso =
gleich)
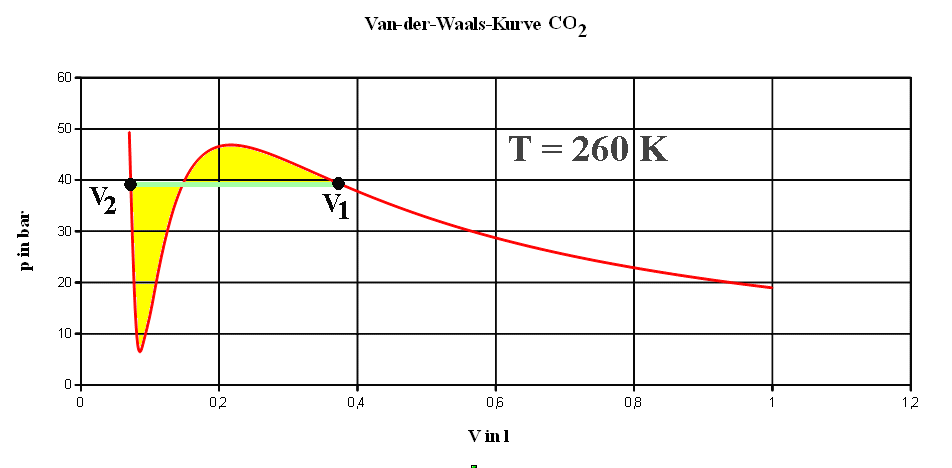 |
Maxwell'sche Konstruktion: Normalerweise
wird zwischen V1 und V2 die grüne Kurve
durchlaufen. Von V1 nach V2 wird immer
mehr Gas in Flüssigkeit verwandelt. Zwischen V1 und V2
"koexistieren" Flüssigkeit und Gas. |
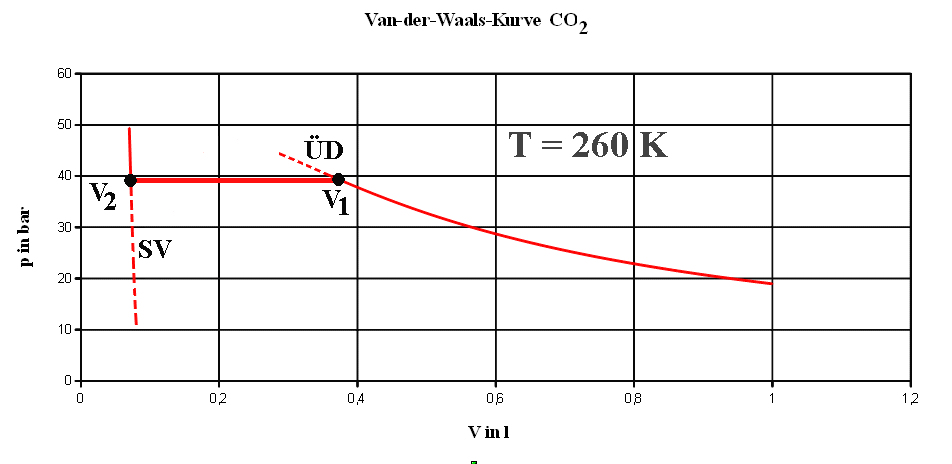 |
Wenn du sehr vorsichtig bist, kannst du noch ein
Stück auf der originalen Van-der-Waals-Kurve marschieren, in den
Bereich ÜD bzw. SV hinein.
Komprimierst du das Volumen über V1
hinaus (oder erhöhst du den Druck), so kann dort weiterhin
allein die Gasphase vorliegen, obwohl dort schon Flüssigkeit
und Gas koexistieren sollten (bei ÜD). Man spricht von einem "übersättigten
Dampf". Er ist möglich beim Fehlen von
Kondensationskeimen, an denen sich Flüssigkeitströpfchen
bilden könnten.
Expandierst du die Flüssigkeit über V2
hinaus (oder verminderst du den Druck), so kannst du es
erreichen, dass sich noch kein Gas (Dampf) bildet (bei SV),
obwohl dort bereits ein Teil der Flüssigkeit verdampft sein
sollte. Man spricht von einem "Siedeverzug". Eine
kleine Erschütterung genügt dort z.B. um explosionsartig
Flüssigkeit in Gas zu verwandeln. Um das zu verhindern geben
Chemiker Siedesteinchen in die Flüssigkeit, auch beim
Erhitzen.
So könntest du auch Wasser über 100 0C
hinaus erhitzen (z.B. auf 107 0C), aber du musst
sehr vorsichtig sein, dass die plötzliche Verdampfung nicht
eintritt und du dich verbrühst.
|
.
( September 2013 )


